近日,大连化物所秦建华研究员团队与中科院昆明动物研究所郑永唐研究员团队合作,建立了一种仿生肠芯片感染模型,研究探索了新冠病毒感染导致的肠屏障损伤、肠粘液细胞分布异常等一系列病理改变,为新冠病毒致病机理、传播途径研究和快速药物评价等提供了新的思路和方法。
新型冠状病毒(SARS-CoV-2)感染已导致全球大流行,构成重大公共卫生危机,严重威胁人类健康。临床发现,新冠病毒感染病人主要以呼吸道症状为主,但仍有20%到50%的患者具有明显的胃肠道症状,包括腹痛、腹泻、便血,甚至肠道穿孔等。另有报道在COVID-19患者的粪便样本中可发现病毒RNA,提示肠道有可能是新冠病毒攻击的另一个主要靶器官。尽管已有基于细胞和动物水平的感染模型,但针对新冠病毒诱发肠道感染的研究并不多,感染机制仍不清楚。特别是现有研究模型仍然存在一定局限,尚难以反映人体肠道组织界面、多细胞组成及粘液分泌等器官特异性关键特征。
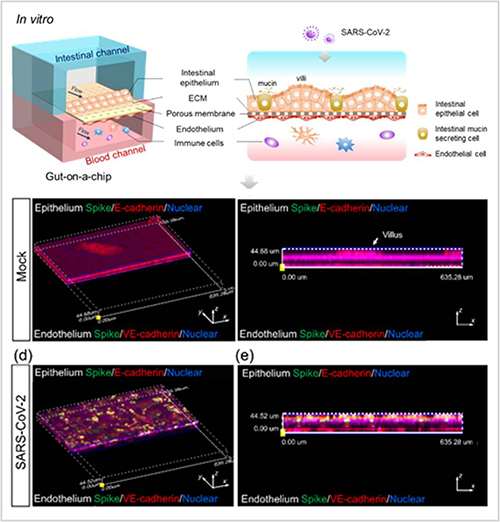
人体内肠道具有消化、吸收和分泌等功能,也是人体最大的免疫器官。肠道组织包含复杂的多细胞成分、肠绒毛结构、粘膜和微生物菌群等,其中肠上皮组织屏障对于维持宿主—微生物稳态和抵御外界病原体感染至关重要。本工作从人体肠道结构和功能特点出发,仿生建立了一种多层设计的可灌注肠芯片装置,模拟包含多种人源肠细胞、组织界面、3D细胞基质和机械流体等复杂因素的肠组织微环境。实验中,研究者通过在多层肠芯片装置上下侧腔室内进行人肠上皮细胞、黏液分泌细胞、人脐静脉血管内皮细胞和人免疫细胞的3D动态共培养,可形成具有人肠上皮—血管内皮界面特征的肠组织屏障,并呈现典型的肠绒毛结构、粘液分泌和屏障完整性等功能。
利用该芯片装置,研究者在中科院昆明动物所BSL-3实验室内开展新冠病毒感染研究。当肠芯片装置暴露于新冠病毒后,在人肠上皮细胞内可见大量病毒复制,同时出现绒毛破坏,粘液分泌细胞分布异常,钙粘蛋白表达水平降低等多种肠组织屏障损伤改变。此外,病毒感染还可导致血管内皮细胞损伤,细胞数量明显减少以及细胞间连接蛋白(VE-cadherin)表达降低等改变。转录组分析发现,病毒感染可诱发人肠上皮细胞和血管内皮细胞出现异常响应,包括免疫反应相关信号通路(如TNF和NF-kappa B)激活、促炎细胞因子和趋化因子相关基因(如TNF,IL-6和CXCL10)表达升高等一系列变化。
本工作中,研究者首次尝试利用微流控仿生肠芯片装置探究新冠病毒诱发的肠道感染,发现新冠病毒可导致人肠组织屏障功能障碍,内皮细胞损伤和炎症反应等一系列病理过程。这种肠芯片感染模型可在一定程度上反映基于组织水平的肠器官生理特点以及对新冠病毒的病理响应,并具有建模周期短、耗费低和易于动态观测等优势。后续工作可进一步结合人体多种肠道免疫细胞和肠道微生物等因素,在芯片上建立更加复杂的肠道免疫微环境,对于深入研究肠道病原体与宿主间相互作用以及病毒传播途径等具有重要意义。
该工作于近日发表在《科学通报》(Science Bulletin)上。